編者薦語:
2021年6月,極目生物創始人及CEO胡海迪博士接受了GBI采訪,分享了極目生物獨特的創新産品管線技術組合,以及清晰的商業化策略與未來發展方向。
* 本文及視頻作者:GBI Health
* 如需轉載引用文中内容或視頻,請聯系授權
自2019年成立以來,極目生物一直緻力于開發眼科疾病創新療法,在獲得一系列國際眼科前沿創新産品的授權後,已然成為中國的新興眼科企業之一。最近,該公司與美國專注于眼科神經療法的公司Olympic Ophthalmics簽訂獨家許可協議,負責後者研發的、用于治療幹眼的外用神經刺激器械 iTEAR®100 在大中華區、韓國和東盟十國的開發和商業化銷售。該産品是極目生物的第五個管線産品。
在極目生物與Olympic Ophthalmics達成合作的前幾天,GBI 有機會采訪到了公司創始人、首席執行官及董事胡海迪博士(Dr. Eddy Wu)。胡海迪博士介紹了公司獨特的目标市場策略,即一方面聚焦前沿創新技術,針對解決未滿足的臨床需求;另一方面聚焦以消費者為導向的産品技術,通過多樣化的營銷渠道覆蓋廣大消費者群體。
GBI獨家訪談 · 本期嘉賓
胡海迪博士 (Dr. Eddy Wu)
極目生物創始人、首席執行官及董事
胡海迪博士是極目生物的創始人、首席執行官及董事。在創立極目生物之前,他曾擔任拓臻生物中國區負責人,負責指導和管理研發活動及業務運營的各個方面。在此之前,他是艾爾建中國的執行醫學總監,負責艾爾建在中國的整體臨床研發、醫學事務和産品管線戰略。
胡博士的職業生涯始于諾華,在諾華公司任職期間,他在巴塞爾、香港和台灣擔任過各種職務,獲得了第一手的全球經驗。在諾華公司總部,他曾擔任AMAC(亞太、中東和非洲國家)、中國和日本的區域醫學負責人和衛生經濟學與成果研究(HEOR)負責人。
胡博士畢業于香港科技大學,獲得生物化學學士及博士學位。
GBI Health
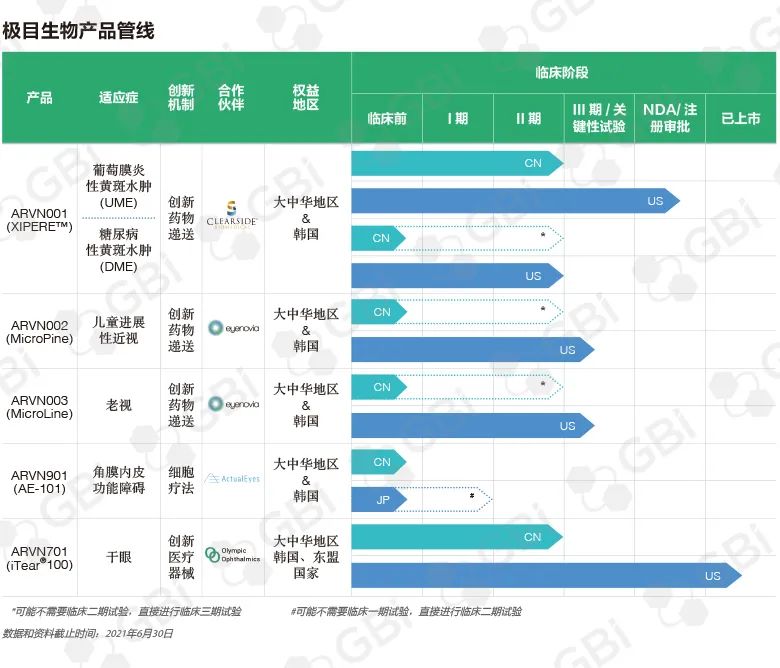
極目生物産品管線
Pipeline of Arctic Vision
GBI獨家訪談 · 胡海迪博士
Q
GBI:貴公司最近與日本ActualEyes公司簽訂的産品引進許可協議針對的是一種真正創新的再生醫學/細胞療法,是一項非常有趣的技術,相比抗 VEGF 藥物顯然具有領先性。請您介紹一下這次合作及合作的産品。
A
胡博士:首先,角膜内皮功能障礙等角膜疾病在中國是一個很大的問題。數以百萬的患者需要進行角膜移植,但由于供體短缺,加上移植手術複雜、對技術要求較高,能夠進行操作的外科醫生數量不足,這些患者無法接受到及時的治療。雖然國内已經開發了供體角膜的替代品,例如動物角膜或合成角膜,但這些産品存在移植排斥等問題。
我們從ActualEyes公司引進的是一種細胞治療技術,從供體角膜中獲取細胞,培養和增殖後植入另一個患者(供體和患者可以不同),以這種方式,我們可以用有限的角膜内皮細胞幫助更多的患者。治療操作過程也比移植更簡單,因為對于患者來說,整個操作過程實質上就是一次注射,然後隻需再俯卧約3小時,在角膜内皮上形成細胞層。操作過程對醫生的技術水平要求較低,即使是普通的眼科醫生也可以進行操作。
Q
GBI:現在我們來看看其它的管線産品,分别與美國生物技術公司 Clearside Biomedical 和 Eyenovia 達成的兩項合作。
A
胡博士:這三款産品的共同點是都代表了前沿創新技術。我們的第一個産品是 ARVN001(曲安奈德脈絡膜上腔注射混懸液),從Clearside Biomedical引進,有望成為我國第一款脈絡膜上腔(SCS)注射給藥療法。在美國,它的商品名是XIPERE™。Clearside Biomedical該産品在美國和加拿大的合作方為博士康(Bausch Health)。我們目前正在開發這款産品用于治療葡萄膜炎性黃斑水腫(UME)和糖尿病黃斑水腫(DME)。由于國内還沒有産品獲批用于一線治療葡萄膜炎性黃斑水腫,ARVN001有潛力成為國内葡萄膜炎性黃斑水腫的一線治療方法。
ARVN001用于葡萄膜炎性黃斑水腫的III期臨床試驗顯示,在進行兩次注射後,47%患者的視力取得了至少 15 個字母的改善。(參考:NCT02595398;https://clinicaltrials.gov/ct2/show/NCT02595398?term=PEACHTREE&draw=2&rank=1)。以我在眼科領域的經驗來講,這個療效數據是非常驚豔的。脈絡膜上腔注射技術是提高療效的主要原因。脈絡膜上腔是界于鞏膜與脈絡膜之間的潛在腔隙,向這個空間注射藥物,可以使藥物很好地存留在非常靠近視網膜的區域。更重要的是,這種技術可以盡量減少對眼睛其他部位的暴露,降低眼壓升高和白内障的風險。藥物注射進入後,可以在脈絡膜上腔中停留好幾個月,不需要依靠不可生物降解或可生物降解的外來成分來維持其療效的持久性。最終達到的是一石三鳥的效果,即在不使用不可生物降解材料的情況下提供更好的療效、更高的安全性和更長的持久性。
葡萄膜炎性黃斑水腫是ARVN001臨床開發的第一個适應症,同時我們還在開發用于治療糖尿病黃斑水腫。已經有數據表明該産品為糖尿病黃斑水腫患者帶來的臨床獲益,國内臨床開發也已在開展中。
Q
GBI:通過第二筆與 Eyenovia 的交易,極目生物獲得了一種非常有趣且可能是世界領先的藥物遞送平台Optejet®。請給我們講一講。
A
胡博士:ARVN002和ARVN003 使用的是微劑量給藥技術,我們稱之為微矩陣藥膜(Micro Array Print, MAP™)。在我看來,這是一個真正的全球範圍創新藥物遞送技術平台。過去使用眼藥水,無論我們多麼熟練,總會有眼藥水從眼睛中溢出,增加了藥物系統暴露的風險。主要是因為眼表隻能容納大約8μL的液體,而滴眼液的給藥量一般為30μL至40μL。因此,長期以來,眼科醫生和技術人員一直在尋找一種能将少量藥物遞送到眼睛表面的解決方案。
這種由Eyenovia開發的微劑量給藥平台Optejet®是一個完美的解決方案。它所使用的技術被稱為MAP™,在每次給藥時,都會将霧化的藥物給至眼表,形成一層完美排列的微小液滴,總體積僅約8 μL,從而減少了藥物系統暴露的風險。此外,這是一款易于使用的智能設備,即使是 3 歲的孩子也可以自己使用。它還可以連接到智能手機上,在需要使用時向用戶發送提醒。我自己也是一個父親,如果有一種方法可以保證我的孩子按時接受治療,并且可以減少副作用,對我來說這将是控制近視的完美解決方案。
我們還将這個技術開發用在了老花眼情境性治療産品ARVN003。老花眼患者可以随時使用該産品,使用一次可在3~4個小時内不用戴眼鏡。你可以看書、與朋友打麻将或上台進行一段演講——都無需佩戴眼鏡。這個産品不需要每天使用,可以放在口袋裡,易于攜帶,比隐形眼鏡還方便,不用戴上再取下。
Q
GBI:通過達成戰略合作,你們獲得了三種處于臨床開發後期的産品。我聽說Clearside最近向 FDA重新提交了 XIPERE™的上市申請,而且 Eyenovia的臨床開發也處于後期階段。請談一談這些對你們公司在國内的發展将産生怎樣的影響?
A
胡博士:是的,ARVN001、ARVN002和ARVN003 這三個産品都是處于非常後期的發展階段。Eyenovia的 MicroPine(用于兒童近視治療的微量阿托品眼用溶液)和MicroLine(用于老花眼治療的微量毛果芸香堿眼用溶液),也就是ARVN002和ARVN003,均處于臨床III期研究階段,Eyenovia幾天前剛剛宣布了MicroLine用于老花眼适應症的 III 期試驗陽性頂線結果。此外,ARVN001也已經在美國提交了上市申請。
我們已經啟動和國家藥監局的溝通程序。顯然,我們希望盡可能地加快産品開發進程。與此同時,還有其他上市途徑可以探索。例如省級特殊通道審批,以及港澳台等其他市場,如果公司計劃在國内進行進一步臨床研究,我們可以嘗試先在港澳台市場啟動。
Q
GBI:在商業化方面,特别是你們公司一些産品将面向廣泛的消費市場,面對激烈的市場競争,極目生物有什麼計劃?
A
胡博士:從第一天起,我們就希望自主進行産品商業化,這一點從未改變。正如我之前提到的,我們公司将有兩個主要的增長引擎。一種是“黑科技”(突破性創新技術),專注于臨床需求未得到滿足的特定領域。ARVN901和ARVN001就是很好的例子,這種類型的産品不需要大量銷售和管理費用投入。但是需要針對這些病症的特定醫師或眼科醫生群體進行良好的醫學教育和操作培訓。
另一個增長引擎将是消費者導向的技術,包括治療近視、老花眼和幹眼産品。對于這種産品,我們将利用新興的電子商務平台,借助KOL的影響力來教育公衆。同樣,這也不是典型的銷售人員驅動的市場模型。我們可以利用互聯網來減少銷售及管理費用,同時産生良性收入。
未來,極目生物的發展道路不會是成為一家擁有大量員工的生物技術公司,而是建立一個高度細分、專注和高效創收的商業模式。
Q
GBI:很期待這一天的到來。我們已經對極目生物通過對外合作迅速地取得成功有了一些了解,我想知道你們公司是否有自主研發計劃?
A
胡博士:授權引進從來都不是公司的“目标”;這隻是我們雙管齊下的增長戰略的一個方面。公司成立初期,國際上有很多先進的技術還沒有進入中國。出于這個原因,我們選擇引進産品作為建立公司基礎的第一步,但我們不會将其作為未來發展的唯一方向。我們在美國有科學家團隊,在中國也在建立一個科研團隊。我們很快将公布公司自主研發戰略,我現在可以透露的是,公司的自主研發将與我們前面提到的雙引擎發展戰略保持一緻,也就是說,開發在技術方面處于領先地位或具有潛力的産品,或者以消費者為導向的産品。
Q
GBI:非常感謝您的時間,我們對極目生物未來的發展充滿期待。
*本文僅截取部分專訪内容。GBI用戶可登錄 GBI SOURCE藥品數據庫 查看本次專訪全部内容。